안녕하세요 Boston 임박사입니다.
최근 유전자 치료제와 세포치료제의 FDA 승인이 점차 이루어지고 있어서 향후 성장성이 기대가 되고 있습니다.
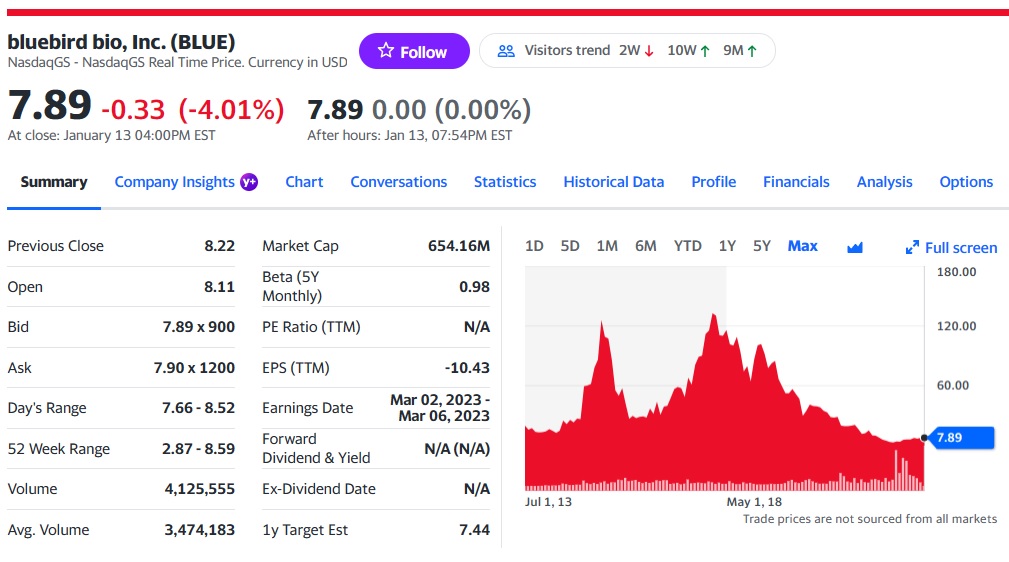
Bluebird Bio는 1992년에 설립된 유전자치료제 Biotech 기업으로 현재 소재지는 미국 Massachusetts주 Cambridge이고 직원수는 519명이며 현재 시가총액은 $654M 입니다.

1992년 MIT교수인 Philippe Leboulch와 Irving London교수에 의해서 Genetix Pharmaceuticals라는 이름으로 설립이 되었습니다. 이 회사는 Lentiviral vector를 이용하여 Ex Vivo로 유전자를 치료하는 기술을 보유한 회사입니다.
2001년에 Walter Ogier를 CEO로 해서 Lentiglobin 유전자치료제의 개발을 시작했고 2010년에 유전병인 beta-thalassaemia 와 Sickle cell disease 환자 각각 5명에 대한 임상1/2상을 진행중인 상태에서 당시 18세였던 한명의 beta-thalassemia환자에 대한 결과를 Nature지에 발표를 했는데 유전자치료제를 맞고 난 후 beta-thalassemia환자는 21개월까지 효과가 지속되는 중요한 결과를 얻었습니다. 이 논문은 처음으로 유전자치료제가 오랜기간 유전병을 치료할 수 있다는 것을 증명한 중요한 결과가 됩니다.
자료출처: Nature 2010, 467, 318-322 Marina Cavazzana-Calvo et al.
이러한 연구결과를 보다 확장하기 위해서 회사명을 Bluebird Bio로 개명하고 Nick Leschly를 CEO로 교체한 후 2013년에 Nasdaq에 IPO해서 $116M을 Funding하였습니다. 이듬해인 2014년에는 Precision Genome Engineering을 최대액 $156M에 인수합니다.
Abecma (bb2121, Idecabtagene vicleucel, Ide-cel) 개발, 승인 및 매출 성장세
2017년 11월에 Celgene과 Anti-BCMA Autologous CAR-T 세포치료제인 Abecma (bb2121, Idecabtagene vicleucel) 공동개발을 발표하고 2020년 5월에 FDA에서 Ide-cel 승인 신청을 거절하였으나 같은해 9월 승인신청을 받아들였고 2021년 3월 31일에 FDA는 승인을 하였습니다. 2019년에 Bristol-Myers Squibb (BMS)가 Celgene을 합병하였는데 Contingent value right (CVR)의 중요한 Milestone 중 하나를 성취한 것입니다. 2021년 10월 8일 항암제 유전자치료제 및 세포치료제 회사인 2seventy bio (TSVT)를 Spin-Off를 발표하고 이후에 상장시켰고 이 회사는 Abecma의 상용화를 BMS와 함께 추진하고 있습니다. 아래는 2Seventy bio의 회사 주식 Chart입니다. 현재 직원수는 437명입니다.

Bristol Myers CAR-T sales rise despite production problems (7/22/2022 Biopharmadive 기사)
2seventy bio Reports Third Quarter Financial Results and Recent Operational Progress (11/7/2022 Bloomberg 기사)
2022년 Abecma의 매출은 $250-300M 정도이고 2023년 매출액 추정치는 $570M 정도로 좋은 상승세를 이어나가고 있습니다. 현재 시장에서 Multiple Myeloma 환자에 대한 Abecma 수요는 매우 높은 상태인데 생산량이 따라가지 못하는 추세여서 계속 생산량을 늘려나가고 있는 중입니다. BMS의 Bryanzi와 함께 동반 매출 성장이 기대되고 있습니다.
Zynteglo (betibeglogene autotemcel, beti-cel, Lentiglobin) 개발 및 승인
2019년 6월에Zynteglo는 유럽에서 beta-thalassemia 유전자치료제로 승인을 받았고 판매 중에 있습니다. 미국의 경우는 부침이 심했는데요. 2021년은 Bluebird bio에게 있어서 가장 큰 시련의 한해였습니다. 3개 유전자치료제가 FDA의 임상중단결정 (Clinical Hold)를 받은 것인데요 그 중 Zynteglo가 이 임상중단결정 뉴스의 시작이었습니다. 2월말에 FDA가 임상중단결정을 통보했고요. FDA Puts bluebird bio’s LentiGlobin on Clinical Hold (2/24/2021 Biospace 기사)
그 이유는 두명의 Sickle cell disease (SCD)환자가 각각 급성백혈병 (AML, acute myeloid leukemia) 증상과 myelodysplastic syndrome (MDS) 증상을 보였기 때문입니다.
하지만 조사결과 급성백혈병 증상은 아닌 것으로 결론이 났고 MDS 증상을 보인 환자의 경우 Zynteglo 유전자치료제로 인한 것이 아닌 것으로 결론이 나서 FDA는 다시 임상시험을 진행하도록 해 줍니다.
FDA lifts clinical hold on bluebird bio’s LentiGlobin studies (6/8/2021 PMLive 기사)
그리고 마침내 2022년 8월에 FDA 승인을 받았으며 이 유전자치료제의 가격은 $2.8M으로 책정되었습니다.
Bluebird’s $2.8 million gene therapy becomes most expensive drug after U.S. approval (8/17/2022 Reuter 기사)
Skysona (elivaldogene autotemcel, eli-cel) 개발 및 승인
Skysona는 2021년 7월 유럽에서 Adrenoleukodystrophy 질환 유전자치료제로 승인을 받았습니다. 하지만 Zynteglo처럼 Skysona의 미국 FDA 승인은 쉽지 않았는데요. 2021년 8월에 Skysona를 임상3상 시험 중 1년 이상 맞은 환자에서 MDS 증상이 발현된 것입니다.
Bluebird bio Takes Hit with FDA Clinical Hold on Gene Therapy (8/9/2021 Biospace 기사)
그리고 한달 뒤인 9월 15일에 임상시험 허가결정을 받게 됩니다. 그리고 FDA의 Accelerated Approval결정을 받게 되었고 (bluebird bio gets green light for Skysona gene therapy in the US 9/19/2022 Biopharma Report 기사)
Bluebird gene therapy overcomes safety worries to snag a win at FDA advisory panel (6/9/2022 Fiercepharma 기사)
이로써 Bluebird bio의 30년간의 연구노력은 마침내 3개의 유전자치료제의 유럽과 미국의 승인으로 상용화를 맞게 되었습니다.
Lovo-cel 개발 및 BLA 일정
2021년 FDA 임상중단결정의 결정타는 매섭게도 12월에 찾아왔습니다. Sickle cell disease (SCD) 유전자치료제 임상3상 환자 중에서 빈혈 증상이 나타난 것입니다. 이것은 부분 임상 중단결정 (Partial Clinical Hold)여서 다른 환자들의 임상진행은 계속 되었습니다.
Bluebird bio hits FDA clinical hold—again—for gene therapy in sickle cell disease (12/20/2021 Fiercebiotech 기사)
이것과 함께 결국 Bluebird bio의 구조조정의 시작을 맞게 됩니다. 먼저 3월에 CFO가 사임을 합니다.
Bluebird Bio has ‘doubts’ about continuing to do business through 2022, announces CFO resignation (3/7/2022 Fiercepharma 기사)
그리고 4월에는 전체 임직원 중 30%에 달하는 대대적인 인력구조조정을 실시하게 됩니다.
Bluebird bio cuts 30% of its workforce as gene therapy dreams dashed in Europe, delayed in US (4/5/2022 Fiercepharma 기사)
다행히 이후에 Skysona와 Zynteglo의 FDA 승인을 받게 됨으로써 어려운 고비는 크게 넘긴 것으로 생각합니다.
올해 1월 9일에 있었던 “Alliance for regenerative medicine” 학회에서 발표한 유전자치료제 및 세포치료제 (Gene Therapy & Cell Therapy)의 현황에 대한 소개입니다. 2022년에 Bluebird bio의 두개의 유전자 치료제 – Zyntegio와 Skysona – 약물이 승인되었구요. 올해 세번째 유전자 치료제인 Lovo-cel의 BLA (Biological License Submission)을 할 예정입니다.
Bluebird bio의 유전자치료제 연구의 결과를 드디어 상용화하는 해가 시작이 된 것입니다.
2021-2022년의 회사의 부침은 주가에서도 확연히 나타납니다. 한때 주당 $120까지 갔던 주가는 이제 $7-8에 거래가 되고 있는 실정입니다. 이제 Turnaround 된 상황이기 때문에 실적과 함께 다시 회사가 빛을 발하기를 바랍니다.
2022년은 유전자치료제 및 세포치료제 승인 개발 역사의 큰 획을 이룬 해입니다. 혁신적인 신약개발에서 거의 항상 겪게 되는 커다란 부침을 극복하고 중요한 신약들이 많이 승인되었습니다.

그리고 아래의 자료는 Bluebird bio에서 올해 2023년 1월에 JP Morgan Healthcare Conference에서 발표한 자료입니다.
2023년 이후 향후 10년 이상 Bluebird bio (BLUE)의 큰 성장을 기대합니다.

One thought on “BIOTECH (28) – Gene Therapy Biotech, Bluebird Bio”