안녕하세요 보스턴 임박사입니다.
이번주에 Iovance Biotherapeutics가 개발하던 최초의 TIL Therapy인 “lifileucel”이 Advanced Melanoma 치료제로서 FDA의 Accelerated Approval을 받았습니다. First-In-Class 혁신신약개발이 그러하듯 lifileucel이 결국 FDA Approval을 받기까지 여정은 결코 쉬운 일이 아니었습니다. 이 신약의 개발 과정에 대해서 나눠보려고 합니다.
1986년 National Cancer Institute (NCI)의 Steven Rosenberg 박사 연구팀은 Tumor-Infiltrating Lymphocytes (TIL)과 Interleukin-2 (IL-2)를 투여하면 고형암의 면역치료제로 가능성이 있슴을 보고했습니다.

Picture: Steven A. Rosenberg. M.D., Ph.D.
Using Tumor‑Infiltrating Lymphocytes to Treat Metastatic Melanoma – The ASCO Post 12/10/2018
The adoptive transfer of tumor-infiltrating lymphocytes (TIL) expanded in interleukin-2 (IL-2) to mice bearing micrometastases from various types of tumors showed that TIL are 50 to 100 times more effective in their therapeutic potency than are lymphokine-activated killer (LAK) cells. Therefore the use of TIL was explored for the treatment of mice with large pulmonary and hepatic metastatic tumors that do not respond to LAK cell therapy. Although treatment of animals with TIL alone or cyclophosphamide alone had little impact, these two modalities together mediated the elimination of large metastatic cancer deposits in the liver and lung. The combination of TIL and cyclophosphamide was further potentiated by the simultaneous administration of IL-2. With the combination of cyclophosphamide, TIL, and IL-2, 100% of mice (n = 12) bearing the MC-38 colon adenocarcinoma were cured of advanced hepatic metastases, and up to 50% of mice were cured of advanced pulmonary metastases. Techniques have been developed to isolate TIL from human tumors. These experiments provide a rationale for the use of TIL in the treatment of humans with advanced cancer.
그리고 1988년 Metastatic Melanoma 환자들을 위한 면역치료제로 가능성이 있슴을 보고했습니다.
이 기술을 임상시험을 통해 상용화를 하기 위해 2007년에 Genesis Biopharma가 설립되었고 2013년에 Lion과 합병되면서 Lion Biotechnologies가 된 이후에 2017년에 Iovance Biotherapeutics로 Rebrand 되었습니다.
Genesis Biopharma Announces Completion of Merger with Lion Biotechnologies – Business Wire 7/25/2013
The merger will create a publicly traded biotechnology company, to be called Lion Biotechnologies, focused on developing T-cell based immunotherapy products for the treatment of cancer. Developed by Steven A. Rosenberg, chief of surgery at the National Cancer Institute (NCI), the company’s core technology has demonstrated robust efficacy in Phase II clinical trials, indicating 50-72% response rates in Stage IV metastatic melanoma.
2022년 5월에 나온 pivotal clinical data로 인해 Iovance의 주가는 크게 출렁였지만 경영진은 lifileucel의 승인을 위해 계속 나아갔습니다.
2023년 7월에 lifileucel의 commercial launch를 위해서 $172.5 Million의 유상증자를 했습니다.
Iovance는 또한번 setback을 경험하는데요. lifileucel BLA를 한 이후에 다른 TIL치료제 “LN-145 TIL” NSCLC 치료제가 임상시험 도중 환자 사망으로 인해 FDA Clinical Hold를 맞게 되었습니다. 이것으로 당시만 해도 lifileucel의 승인에 빨간불이 켜진게 아닌가 하는 우려가 있었습니다.
US FDA puts clinical hold on Iovance’s cancer therapy trial – Reuters 12/27/2023
그러나 이런 우려를 불식하고 마침내 2월 16일에 FDA로 부터 Accelerated Approval을 받게 된 것입니다.
FDA Approves First One-time Cell Therapy for a Solid Tumor – Biospace 2/16/2024
CAR-T치료제가 세포면역항암제로 승인이 많이 되었지만 주로 혈액암에서만 효과를 발휘할 뿐 고형암에서는 기대에 미치지 못했습니다. TIL 치료제의 경우는 고형암인 Melanoma에서 효과를 발휘함으로써 이번 승인은 TIL을 통한 고형암 세포면역항암제의 승인이라는 의미가 있습니다.
Iovance completed its rolling BLA submission to the FDA in March 2023, backed by clinical data showing that lifileucel elicited a 31% objective response rate with a median duration of response not reached at 18.6 months follow-up, with 42% of responses lasting for two years or longer.
기존의 TIL Manufacturing 시간은 6주였으나 Iovance는 22일만에 생산할 수 있도록 대폭 개선하였고 2021년에 GMP 공장을 자체적으로 건설하였습니다.
Iovance, however, does not expect to run into any manufacturing snags, Chief Operating Officer Igor Bilinsky told BioSpace earlier this month, adding that the company has shortened the manufacturing time for lifileucel from six weeks to 22 days. The company instituted its first centralized cell therapy center in Philadelphia in 2021 to keep up with the potential rise in demand.
NCI가 보유한 lifileucel 특허는 Iovance Biotherapeutics로 이전되었습니다.
2024년 2월 16일에 발표한 Iovance Biotherapeutics의 Corporate Presentation에 나타난 Pipeline은 다음과 같습니다.
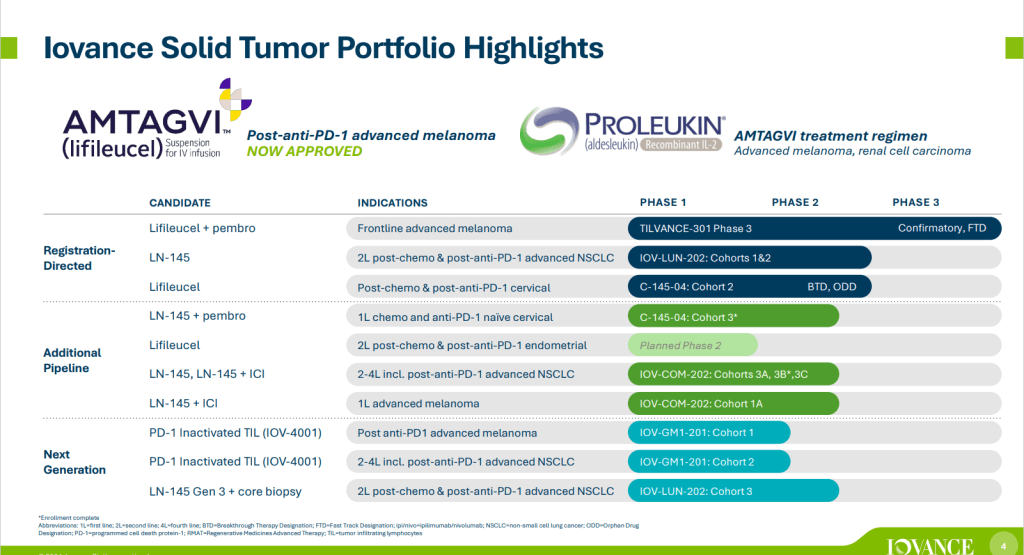
lifileucel이 Advanced Melanoma 환자 치료에 활용될 수 있는 길이 열리는 데까지 1986년부터 거의 40년 가까운 시간이 걸렸습니다. 정말 오랜 기간 이 치료제의 성공을 위해 애쓴 Iovance의 과학자들에게 박수를 보냅니다.
