
안녕하세요 보스턴 임박사입니다.
현재 한국의 암환자들이 CAR-T치료제 치료를 받으려면 해외로 시료가 나가고 Autologous CAR-T 치료제가 만들어져서 QA/QC를 모두 통과하고 국내로 돌아와 환자가 다시 맞는데까지 너무 많은 시간이 소요됩니다. 이번에 한국 바이오텍이 자체개발한 CAR-T치료제로 한국의 환자들을 직접 치료할 수 있는 좋은 결과가 나온 것으로 생각해서 이에 대해 글을 남기려고 합니다.
큐로셀 (Curocell)은 2016년 당시 차바이오텍에 근무하던 김건수 대표가 KAIST 생명과학과 김찬혁 교수 (현재 서울대학교 교) 와 이화여대 심현보 교수와 함께 CAR-T, CAR-NK 세포치료제 개발을 위해 12월에 공동창업하게 됩니다. 본래 이 세사람은 서로 모르는 사이였는데 오름테라퓨틱스 이승주 대표의 소개로 의기투합하게 되었다고 합니다.


2017년에 인터베스트와 미래에셋캐피털로 부터 20억원의 시리즈A를 하고 2019년에 150억원의 시리즈B를 하게 됩니다. 스틱벤처스가 새롭게 참여했습니다. 이 자금으로 2020년 3월에 삼성서울병원 미래의학관 내에 GMP공장을 완공했고 2021년 2월에 식품의약품안전처로 부터 IND를 승인받아 임상1/2상을 시작했습니다. 2022년 1월에는 St. Jude Hospital로 부터 Lentivirus vector 기술도입을 했고 2023년 4월에는 신규 사옥(연구소, 본사) 및 상업용 GMP 공장을 완공(과학벨트 둔곡신동 거점지구)했습니다. 2023년 11월에 기술특례상장으로 코스닥 상장을 했고 최근 anti-CD19 CAR-T 치료제 안발셀 (Anbal-cel, Anbalcabtagene autoleucel)의 긍정적인 임상2상 데이타를 발표했고 식약처의 승인을 신청한 상태입니다.
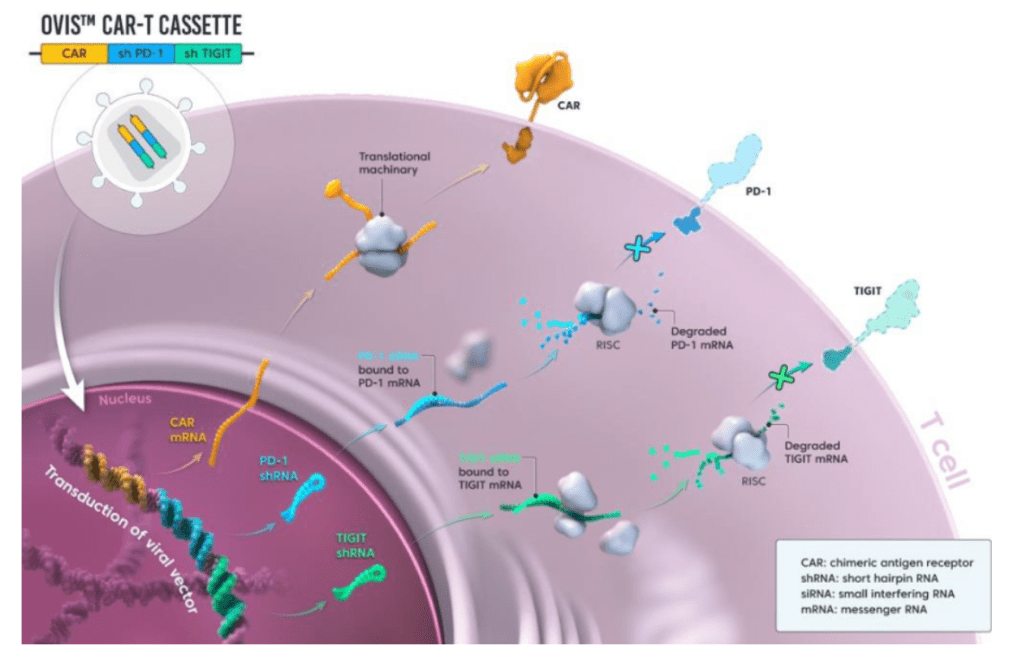
PD-1과 TIGIT을 동시에 downregulation했을 때 CD19 CAR-T의 효능이 증대됨을 아래에서 보여주고 있습니다.

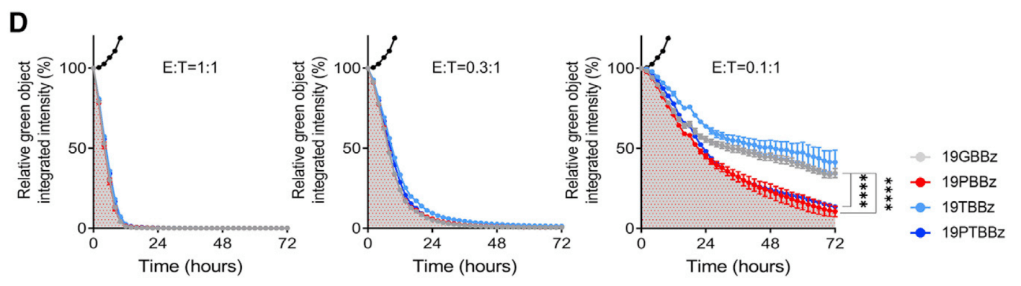
19PBBz (PD-1 downregulation) 19TBBz (TIGIT downregulation)에 비해 19PTBBz (PD-1/TIGIT Dual downregulation)이 CAR-T 치료의 지속성이 높은 것을 보여줍니다.
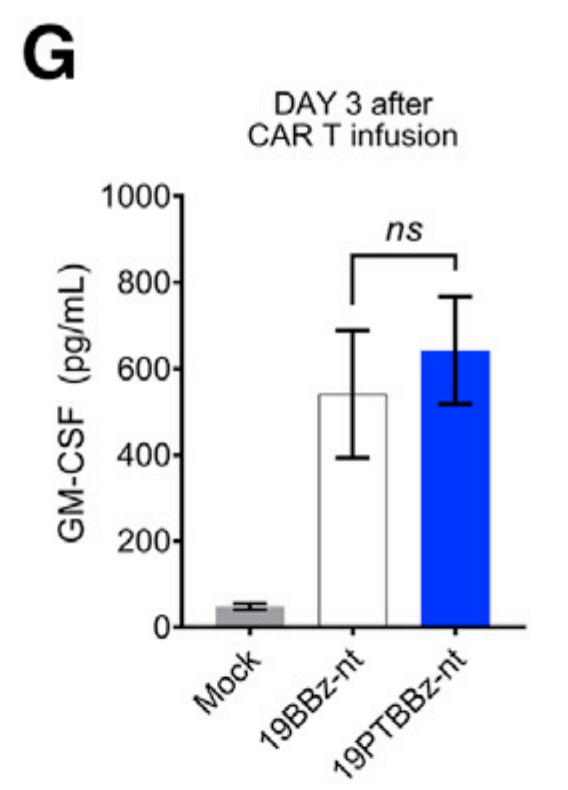
19BBz-nt에 비해 19PTBBz-nt (PD-1/TIGIT Dual downregulation)에서도 백혈구의 GM-CSF level이 높게 나온 것으로 볼 때 CAR-T치료제의 독성인 CRS (Cytokine Release Syndrome)과 ICANS (Immune effector Cell-Associated Neurotoxicity Syndrome)이 적을 것으로 기대할 수 있었습니다. (G)
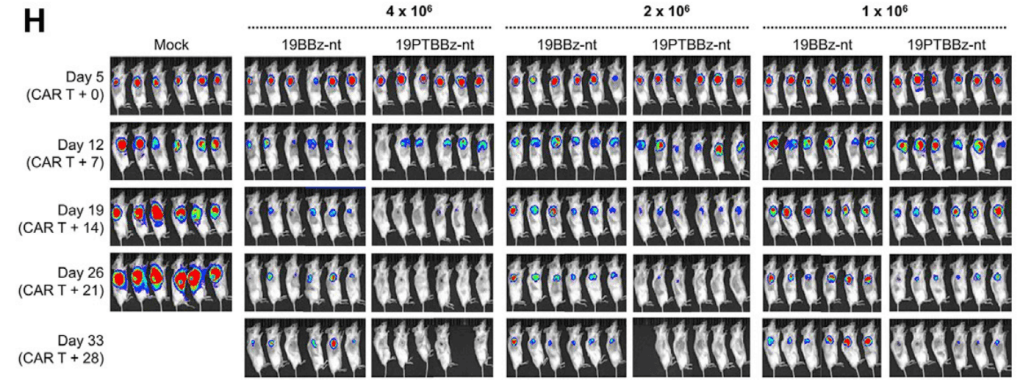
Subcutaneous Raji-PD-L1 Lymphoma in vivo model에서 19PTBBz-nt (PD-1/TIGIT Dual downregulation)와 19BBz-nt의 in vivo efficacy를 보았을 때, 19PTBBz-nt (PD-1/TIGIT Dual downregulation)가 19BBz-nt 보다 모든 dose level에서 개선된 항암효과를 보였습니다.
Molecular Therapy 2022년 논문 원본은 아래에 링크합니다.
삼성의료원 김원석 교수팀은 2022년에 Anbal-cel의 r/r large B-cell lymphoma (r/r LBCL)에서의 임상1/2 상 결과를 발표했습니다.

CAR-T 치료 전 3일간 Lymphodepletion with cyclophosphamide (500mg/m2) and fludarabine (30mg/m2) 을 수행했습니다. 그리고 세가지 Dose에서 한차례씩 IV 주사를 실시했습니다. 총 9명의 환자에게 시행했고 이 중 한분은 중환자실에 입원 (Grade 3), 5명 (56%) 은 CRS (Cytokine Release Syndrome) 독성을 보였습니다. 이 정도 독성은 CAR-T치료제에서 일반적인 것입니다.
9명 중 7명 (78%)이 CR (완전관해)를 보였는데 가장 낮은 용량이 3명, 중간과 최고 용량이 각각 2명이었습니다. 이 결과를 바탕으로 2022년 3월에 임상2상을 시작한다고 발표했습니다.
Background: Anbal-cel is a novel 2nd generation autologous CD19 CAR-T cell therapy which has been knock-downed for PD-1 and TIGIT using OVIS platform. Anbal-cel demonstrated the eradication of CD19 positive tumor cells in vitro and in vivo better than conventional CD19 CAR-T cells. The knock-down of PD-1 and TIGIT at CD19 CAR-T cells exerts the superior T-cell functionality by delaying the exhaustion of CAR-T cells.
Methods: This phase 1 dose escalation part (NCT04836507) was evaluated the safety and preliminary efficacy in patients with r/r LBCL. Anbal-cel was manufactured at GMP facility with fresh leukapheresis product. Patient was administered as a single intravenous dose at dose level 1 (DL1) (2×105 cells/kg), DL2 (7×105 cells/kg) or DL3 (2×106 cells/kg). Lymphodepletion with cyclophosphamide (500mg/m2) and fludarabine (30mg/m2) was performed for 3 days prior to Anbal-cel infusion.
Results: As of Jan 17 2022, 9 patients with r/r DLBCL were infused with Anbal-cel; 4pts at DL1, 3pts at DL2 and 2pts at DL2. Median age was 54 (range 26-71); all patients received 2 or more prior lines of therapy and 44% (4/9) received ≥4 prior line of treatment before the study. 78% (7/9) patients were refractory to their last treatment. 67% (6/9) of patients were at IPI 3-4 and 44% (4/9) of patients had bulky disease. No patient experienced DLT during the study. Of the 9 patients, 5 (56%) experienced CRS; 4 (44%) were grade 1 or 2 and one patient experienced grade 3 CRS. Median time to onset of CRS was 7 days (range, 1-16) with median duration of 4 days (range, 0-18). One patient dosed at DL3 experienced grade 2 ICANS, time to onset of ICANS was 7 days and lasted for 13 days. This patient had prior CNS involvement history before the study. Most commonly reported grade 3/4 AEs were neutrophil count decrease (6/9, 67%), anemia (5/9, 56%), thrombocytopenia (2/9, 22%), platelet count decrease (2/9, 22%) and no infection was reported. Complete response rate (CRR) was 78% and complete responses were observed at the lowest dose level and from patients expressing less than 10% CD19 at IHC; 3 complete responses (CR) at DL1, 2 CRs at DL2 & DL3 respectively. Dose-dependent CRC01 expansion was observed; median Tmax was 15.4, 15.8, 11.0 days at DL1, DL2 & DL3 each; median Cmax was 18,003, 30,103, 53,688 copies/ug gDNA at DL1, DL2 & DL3 each; median AUC0-28day was 679,125, 1,110,108, 2,852,235 copies/ug gDNA at DL1, DL2 & DL3 respectively.
Conclusions: Anbal-cel demonstrated promising efficacy and tolerable safety profile in this dose escalation study. Based on this phase 1 study, phase 2 patient enrollment will be commenced in Mar 2022 to evaluate the response rate, duration of response of CRC01 as well as safety. In addition, various biomarker studies are planned to investigate the differential mode of action of Anbal-cel during phase 2 study. Clinical trial information: NCT04836507.
삼성의료원 김석원 교수팀은 2023년에 임상2상 중간결과를 발표했습니다. 임상1상에서 최고용량이었던 2×106 cells/kg으로 r/r LBCL환자들에 대해 Biomarker analysis를 한 것입니다. 완전관해를 받지 못한 환자들의 경우에는 PD-1, TIGIT 등의 관문유전자 레벨이 상승한 것을 관찰해서 완전관해와 메카니즘 적으로 PD-1과 TIGIT 레벨이 중요한 영향을 끼침을 발표했습니다.
Background: Anbalcabtagene autoleucel is a novel anti-CD-19 CAR-T therapy that has shown promising clinical results, with a complete response (CR) rate of 73.7% in relapsed or refractory LBCL patients at interim analysis. This biomarker analysis aims to understand the mechanism associated with the treatment outcome.
Methods: Patients with relapsed or refractory LBCL were enrolled to receive Anbal-cel at a dose of 2×106 cells/kg. Tumor biopsies were performed at baseline to assess the expression levels of CD19, PD-L1, and CD112/CD155. Peripheral blood mononuclear cell (PBMC) samples for immune phenotyping and serum sampled for ctDNA analysis were collected at day 0, 14, 28, and 3-month intervals thereafter until progression.
Results: PD-1 and TIGIT were highly expressed on baseline PBMC. PD-1 was expressed more on CD8+ CAR+ T-cells whereas TIGIT on CD4+ CAR+ T-cells. PD-1, LAG-3 and TIM-3 expressions were significantly increased from D14 at non-CR group. TIGIT expression was significantly increased at D28 at non-CR group. The non-CR group demonstrated the significantly increased level of IL-4+/ IL-5+ Th2 type CAR+ T-cells whereas GATA+Th2/Tc2 type CAR+ T-cells were significantly lower in non-CR group. Additionally,
CD57+CD27-CAR+ T-cells, a marker of terminal differentiation/ functional senescence, were significantly increased in the non-CR group from D14. CD226+ CAR+ T-cells were also significantly lower in the non-CR group. CD45RA+ CAR+ TEFF/EMRA cells postinfusion were significantly lower in the non-CR group and CD38+HLA-DR+ CAR+ T-cells, a marker of susceptibility of cell death, were significantly higher in the non-CR group.
The activation of CAR+ T-cells measured by ICOS, 4-1BB, CD226 and CD94 was not different between the two groups. The most frequently detected mutations were related to cell cycling, epigenetic regulation, immune escape, apoptosis etc. Changes in ctDNA concentration were reversely correlated with treatment outcome.
Conclusions: Anbal-cel’s unique immunologic and genetic changes demonstrated potential to correlate with treatment outcomes and warrant to confirm with more data.
Clinical trial identification: CRC01-01 (NCT04836507).
Legal entity responsible for the study: Curocell Inc.
Funding: Curocell Inc.
Disclosure: Y. Koh: Financial Interests, Institutional, Advisory Board: Curocell. J.R. Kim: Financial
Interests, Personal, Member: Curocell. All other authors have declared no conflicts of interest.
그리고 최근 73명의 임상시험 결과 CRR (완전관해율)은 67%였고 ORR (객관적 반응률)은 75%였다고 발표했습니다. 이 결과가 맞다면 아주 좋은 결과입니다. 물론 미국이나 유럽 임상에 비해 인원수가 적은 문제는 있지만 국내 r/r LBCL 환자수를 보았을 때는 식약처에 승인요청을 할만한 결과를 얻은 것으로 볼 수 있을 것 같습니다. 금년 하반기에 식약처에 승인요청을 할 예정이라고 공시했습니다.
큐로셀, 차세대 CAR-T 치료제 ‘안발셀’ 임상시험 성공 발표 – 큐로셀 보도자료3/7/2024
■ 거대B세포림프종(LBCL) 환자 대상 임상 2상시험에서 완전관해 67.1% 확인
■ 차세대 기술이 적용된 최초의 국내 개발 CAR-T 치료제로 연내 신약허가 신청 예정
큐로셀(대표이사 김건수)이 재발성, 불응성 거대B세포림프종(LBCL) 환자를 위한 차세대 CAR-T 치료제 ‘안발셀(Anbal-cel)’의 임상 2상시험 톱라인 데이터를 수령했다고 6일 공시했다.
임상2상 최종 데이터 분석 결과 임상시험 유효성 분석 대상자 73명 중 안발셀 투여 후 암세포가 모두 사라진 완전관해에 도달한 비율(CRR)은 67.1%였다. 이는 글로벌 시장에 출시된 CAR-T 치료제들의 기존 임상시험 결과와 비교해 가장 우수한 완전관해율이다. 또한 일차 평가변수인 객관적반응률(ORR, 전체 환자에서 약물의 객관적 반응이 나타난 환자 비율)은 75.3%이었다. 최종 결과는 임상시험 설계 당시 가정했던 통계적 유의성을 확보했다.
이번 결과는 2개 차수 이상의 치료에 재발 또는 불응하는 거대B세포림프종(LBCL) 환자를 대상으로 안발셀을 단회 투여한 후 안전성 및 유효성을 평가하는 공개, 다기관, 단일군 임상시험을 통해 얻어진 것이다. 해당 임상은 2022년 3월부터 2023년 10월까지 만 22세~85세 성인남녀 79명을 대상으로 삼성서울병원 등 6개 기관에서 수행한 임상 2상으로 국내 최초의 CAR-T 치료제 임상시험이다.
큐로셀은 이번 임상 결과를 토대로 올해 하반기 국내 신약허가를 신청할 예정이다. 안발셀의 신약허가 획득 시, 우리나라는 미국, 중국, 인도에 이어 자체적으로 CAR-T 치료제를 개발한 네 번째 국가가 될 전망이다.
큐로셀은 국내 최대 규모(1만 636m2)이자 글로벌 수준의 CAR-T 치료제 전용 상업용 GMP를 보유한만큼 신약허가 획득 후 국내 제조를 통한 공급을 진행할 계획이다.
큐로셀 김건수 대표는 “지난 3년간 매진했던 임상시험을 성공적으로 마무리해서 매우 기쁘고 관련한 모든 분들께 감사 인사를 드리고 싶다. 이번 최종 결과에서 안발셀의 높은 경쟁력을 확인한 만큼 향후 신약허가와 출시가 빠르게 진행되도록 최선을 다할 것”이라고 밝혔다.
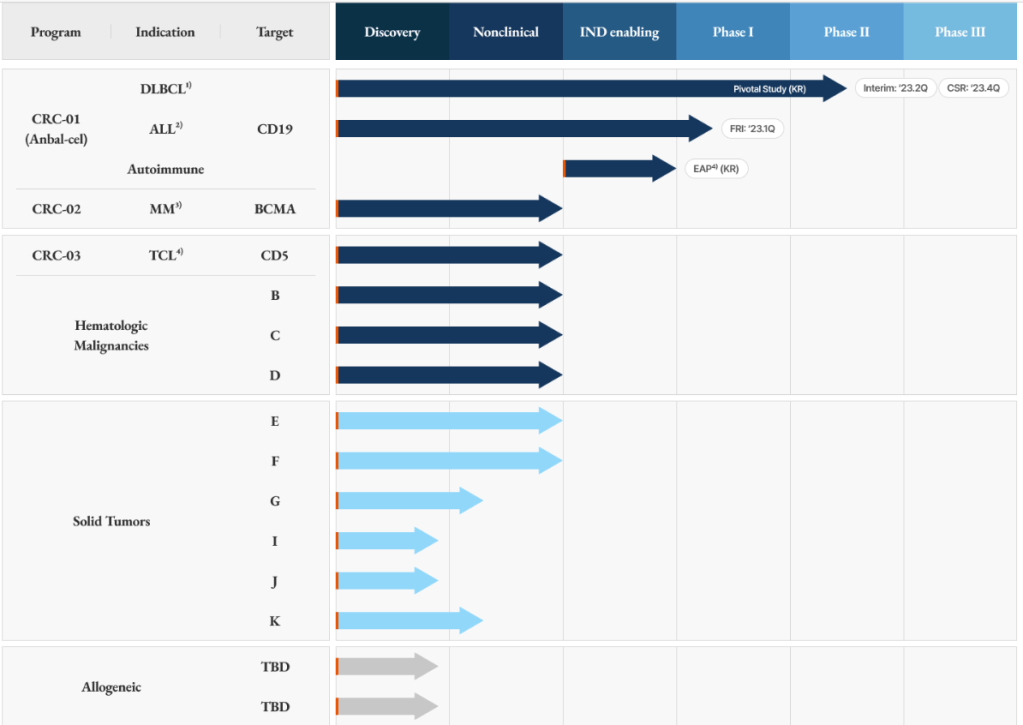
회사의 홈페이지에 개재한 파이프라인은 다음과 같습니다. Anbal-cel은 현재 ALL (급성림프구성백혈병) 환자에 대해 임상1상을 진행 중에 있습니다.
‘국내 첫 CAR-T 기업’ 큐로셀, 시리즈B 150억 유치 – 바이오스펙테이터 1/23/2019
큐로셀이 시리즈B로 150억원 규모의 투자자금을 유치했다고 23일 밝혔다. 기존 투자기관으로 인터베스트, 미래에셋캐피털이 후속 투자를 했고, 타임폴리오자산운용, 스틱벤처스가 새롭게 참여했다. 큐로셀은 2년전에 시리즈 A로 20억원을 투자받은 것을 포함해 총 170억원을 확보하게 됐다. 이번 자금유치를 통해 큐로셀은 임상 진입을 위한 연구개발 가속화하고 임상의약품 제조용 GMP시설 구축에 집중할 계획이다. 큐로셀은 제약업계에 다년간의 경험을 가진 김건수 대표와 T세포 치료제 전문가 KAIST 김찬혁 교수와 항체 전문가 이화여대 심현보 교수가 함께 창업한 국내 최초의 CAR-T 치료제 전문회사다. 큐로셀은 기존 CAR-T치료제의 한계를 극복하는 차세대 CAR-T 기술 개발에 포커스한다. 핵심 기술로 암세포를 인식할 수 있도록 CAR발현과 동시에 면역관문수용체를 통한 면역억제현삼을 극복할 수 있는 CAR-T 기술을 이용해 혈액암, 나아가 고형암 치료에 도전하고 있다. 최근 큐로셀은 2020년 차세대 CD19 CAR-T의 임상1상 진입과 신규 프로젝트 발굴을 위하여 삼성서울병원과 업무협업계약을 체결했다. 회사는 기초연구, 임상연구 및 임상의약품생산 등 면역항암세포치로제 개발 관련 전분야에 걸쳐 협업체계를 구축했다. 김건수 대표는 “큐로셀의 가치를 믿어 주신 투자자 분들께 감사드리며 삼성서울병원과의 업무협약에 이어 시리즈B 투자유치로 세계적으로 뒤처져 있는 국내 CAR-T 분야에서 빠른 임상 데이타 확보를 통해 기술력을 증명해 보이겠다”라고 밝혔다.
큐로셀, 시리즈C 440억 투자..”차세대 CAR-T 연내 임상” – 바이오스펙테이터 6/10/2020 김성민 기자
국내 최초 CAR-T 치료제 개발 전문기업인 큐로셀 (Curocell)이 440억원 규모의 시리즈C 투자유치에 성공했다. 큐로셀은 이에 앞서 지난해 1월 시리즈B 150억원 투자유치를 했으며, 이로써 지금까지 총 누적금액은 615억원이다. 큐로셀은 내년 상장을 계획하고 있다. 이번 시리즈는기존투자기관인 스틱벤처스, 에이티넘인베스트먼트가 후속투자를 진행하였고 DS자산운용, 서울투자파트너스, IMM인베스트먼트, 아주IB투자, 얼머스인베스트먼트, LB인베스트먼트, 유경PSG자산운용, 이앤벤처파트너스, JX파트너스, 컴퍼니케이파트너스, K2인베스트먼트파트너스, 쿼드자산운용, 하나벤처스 등 신규 투자기관이 대거 참여했다. 이번 투자금은 차세대 CD-19 CAR-T 치료제인 ‘CR101’의 연내 임상 개시와 후속 파이프라인 개발을 가속화하는데 투입된다. CR101은 기존의 킴리아, 예스카타 등 CD19 CAR-T 약물의 디자인에서 T세포 항암 활성을 억제할 수 있는 면역관문분자 TIGIT과 PD-1 발현을 낮춘 약물이다.
큐로셀, Pre-IPO 360억 투자 유치 – 히트뉴스 1/3/2022 남대열 기자
CAR-T 치료제 개발 전문기업인 큐로셀이 360억원의 Pre-IPO 투자 유치에 성공했다고 3일 밝혔다. 2020년 시리즈C 투자를 유치한 지 1년4개월 만에 이뤄진 Pre-IPO 투자다.
이번 투자에는 기존 투자기관 중 스틱벤처스, DS자산운용, 서울투자파트너스, 유경PSG자산운용, JX파트너스, 쿼드자산운용이 참여했고, 문채이스자산운용, 위드윈인베스트먼트, 아드바이오테크투자조합이 신규 재무적 투자자로, SK플라즈마가 전략적 투자자로 나섰다.
SK플라즈마는 큐로셀이 개발하고 있는 차세대 CAR-T 제품의 국내 및 해외사업화를 공동으로 추진할 예정이다.
큐로셀 관계자는 “이번 투자유치를 통해 최근 착공한 국내 최대 규모의 CAR-T 치료제 전용 GMP 공장 건설과 현재 국내에서 임상을 진행하고 있는 차세대 CD19 CAR-T 치료제인 ‘CRC01’의 임상시험을 가속화 할 계획”이라고 말했다.
한편, 이번 Pre-IPO 투자 유치로 큐로셀은 회사 설립 이후 5년 간 총 975억원의 투자를 유치했으며, 올해 하반기 코스닥 상장을 계획하고 있다.
큐로셀, 공모가 밴드하회 “2만원 확정, 320억 조달” – 바이오스펙테이터 10/30/2023 김성민 기자
CAR-T 전문기업 큐로셀 (Curocell)이 공모가를 확정하고 내달 9일 상장할 예정이다. 큐로셀은 수요예측 결과를 반영한 최종 공모가로 희망 공모가밴드 (2만9800 ~ 3만3500원) 아래인 2만원으로 확정했다고 30일 공시했다. 이에 따라 총 공모규모는 320억원으로 줄어들었다. 확정공모가액 기준 시가총액은 약 2723억원이다. 큐로셀은 이번에 조달한 공모자금으로 현재 진행중인 차세대 CD19 CAR-T치료제 안발셀 (Anbal-cel, 성분명 안발캅타진 오토류셀)의 상업화와 함께 다발성골수증, T세포림프종, 고형암 등 새로운 파이프라인 개발에 투자할 계획이다. 김건수 큐로셀 대표는 “최근 주식시장의 분위기가 좋지 않았다. 특히 바이오기업들이 유독 더 어려움을 겪고 있는 상황에서 신규 상장 바이오 기업으로서는 올해 가장 큰 규모의 공모를 마무리하게 됐다”며 “어려운 시장 분위기에서도 큐로셀에 대한 믿음을 갖고 공모에 참여해 주신 투자자분들께 감사드린다”고 말했다. 이어 김대표는 “국내 최초로 CAR-T 치료제 개발을 시작하여 새로운 시장을 개척하고 있는 규로셀만의 기술력과 노하우를 기반으로 상장 후 글로벌 경쟁력을 갖춘 혁신적인 항암면역세포 치료제 전문 기업으로 도약하겠다”고 밝혔다. 큐로셀의 총 공모 주식 수는 160만주로 오는 31일부터 11월 1일까지 양일간 일반 투자자 청약을 진행한 뒤, 11월 9일 코스닥 시장에 상장할 예정이다. CAR-T치료제는 환자의 혈액에서 분리한 면역세포인 T세포를 유전적으로 조작해 암세포를 효과적으로 제거할 수 있도록 한 세포유전자치료제다. 림프종 등 혈액암 치료제에서 높은 반응률과 완전관해를 (CR rate)를 뵈며 전세계에서 주목받고 있다. 큐로셀은 국내 최초로 설립된 CAR-T 개발 전문기업으로 최근 안발셀의 거대비만성B세포림프종 (DLBCL) 대상 임상2상을 완료하고 내년 9월 신약허가 신청을 계획하고 있다. 큐로셀은 CAR-T 세포의 기능 저하 원인인 억제성 면역관문분자 PD-1, TIGIT 의 발현을 낮추는 OVIS 기술을 개발해 CAR-T의 기능을 강화하며 치료 효과를 높이겠다는 목표이다. 큐로셀은 국내를 비롯한 해외 25개국에 OVIS의 특허를 출원 중이며 현재 한국과 미국, 유럽, 일본 등에서 특허 등록이 완료됐다.
기적의 항암제 CAR-T로 승부수, 30명 벤처가 쓰는 신화 – 헬로디디 11/4/2020 김인한 기자
36명 벤처가 없던 길을 만들고 있다. 국내에선 누구도 가보지 않은 길이다. ‘기적의 항암제’라 불리는 CAR-T세포 치료제만을 개발하기 위해 설립된 바이오벤처 ‘큐로셀’ 얘기다. CAR-T세포 치료제는 말기 혈액암 환자 치료에서 80%까지 차도를 보이면서 2017년 미국 식품의약국(FDA)도 허가한 면역항암제다. 그러나 국내에선 아직 기술 축적이 이뤄지지 않아 개발되지 못하고 있다.
국내에서 누구도 엄두를 내지 못하는 가운데, 대덕 바이오벤처 큐로셀은 글로벌 제약사를 뛰어넘는 기술력을 입증하며 업계를 뒤흔들고 있다. 큐로셀은 T세포에 키메릭 항원 수용체(CAR)를 붙이는 유전자 조작을 넘어 면역관문 수용체 2종(PD1, TIGIT)을 제거하는 독보적 기술로 도전장을 던졌다. 글로벌 바이오 기업 대다수가 면역관문 수용체 하나(PD1)만을 제거한다. T세포 표면에는 면역관문 수용체가 여러 개 있는데, 여기에 암세포가 악수를 하듯 들러붙으면 T세포가 기능을 상실한다.
김건수 대표는 “유전자 조작을 통해 T세포에 CAR를 붙이는 건 어느 기업이나 할 수 있는 기술”이라면서 “대다수 기업들이 PD1 면역관문 수용체 하나만을 제거하지만, 내부에서 여러 조합을 테스트해본 결과 PD1과 TIGIT을 없앴을 때 CAR-T 치료 효능이 극대화된다”고 했다.
큐로셀의 독보적인 기술력을 알아본 건 국내 투자사들과 삼성서울병원이다. 큐로셀은 현재까지 총 615억원을 투자받았다. 삼성서울병원은 큐로셀이 개발하고 있는 CAR-T세포 치료제를 원내에서 생산할 수 있도록 내부 공간 495m2(150평)까지 내줬다. 그곳에 올해 초 CAR-T세포 치료제를 생산할 수 있는 GMP 시설이 완공됐다. 시운전과 자체 생산 테스트까지 끝난 상황으로 정부(식품의약품안전처) 임상 허가를 기다리고 있다.
◆ 개척 정신
김 대표는 어린 시절부터 틀에 박힌 일보단 하고 싶은 일을 찾아 나섰다고 한다. 새로운 일에 두려움 없이 나아가는 아버지 영향이 컸다. 그는 연세대 생명공학과에서 학·석사를 마치고 당시 한화석유화학중앙연구소, LG생명과학, 차바이오텍 등을 거치면서 CAR-NK세포에 관심을 두기 시작했다. 2015년 CAR-NK세포 치료제를 시작으로 CAR-T세포 치료제를 독학하던 시기 아버지가 암으로 세상을 떠났다. 이듬해 그는 운명처럼 면역항암제만을 전문으로 하는 바이오벤처를 설립해 이전에 없던 길을 나아가고 있다.
김 대표는 “암 환자에게 CAR-T세포 치료제는 마지막까지 해볼 수 있는 가능성 높은 치료”라면서 “암 환자에게 효능이 있다고 증명된 만큼 국내에도 반드시 있어야 하는 치료제라고 생각했다”고 말했다.
김 대표는 어려움을 묻는 질문에 “연구개발을 하고 결과를 기다리는 입장에서 미래에 대한 불확실성은 늘 있는 것이고 그걸 난관이라고 할 수는 없다”면서도 “국내에서 CAR-T는 모든 게 처음이기 때문에 물건을 사거나 원료를 주문 생산해야 하는 상황 하나하나가 난관이지만 극복해나가고 있다”고 했다.
◆ “목마른 사람이 우물 판다”
김 대표는 연구원 생활을 본격 시작한 2000년부터 창업 전까지 커리어 15년을 연구자와 기획자로 절반을 살았다. 그는 이 시기 연구에 대한 전문성도 키웠지만, 기획자로서 커뮤니케이션 내공을 쌓았다고 한다. 그는 “기획 일을 하면서 얻은 건 사람들 간 이해관계 조정이나 연구 분야에 대한 존중이 필요하다는 점”이라고 설명했다.
그는 이런 내공을 통해 큐로셀을 CAR-T 최고 전문가들로 채웠다. 이승주 오름테라퓨틱 대표를 통해 김찬혁 KAIST 생명과학과 교수를 소개 받아 사업을 고도화시켰고, 항체 전문가인 심현보 이화여대 교수도 영입했다. LG화학에서 바이오시밀러 개발을 책임지던 김형철 현 큐로셀 상무를 데리고 오기도 했다. 기획 일을 하면서 커뮤니케이션 내공, 사람 만나는 일에 거리낌 없는 김 대표의 능력이 진가를 발휘한 것이다.
김 대표는 “혹자는 아무것도 없는 상황에서 어떻게 창업할 수 있느냐고 묻지만, 어느 기업보다 창업 멤버들이 훌륭하고 아이템도 세계적으로 유망하기 때문에 여러 면에서 불안할 요소가 없는 비즈니스”라고 자신감을 드러냈다.
삼성서울병원 GMP 시설을 구축하는 과정에도 김 대표는 서울대병원과 삼성서울병원 등을 직접 찾아 나섰다. 당시 CAR-T세포 치료제에 대한 회의적인 시각도 있었지만, 좌절하지 않고 그간 쌓아 온 내공과 기술력으로 삼성서울병원 내부에 GMP 시설을 구축했다.
김 대표는 “목마른 사람이 우물을 파는 것”이라며 “사람 안 만나고 일할 수 없고, 일을 하려면 무엇이든 부딪쳐봐야 한다”고 했다. 이어 “움직이지 않으면 누군가 대신해줄 수도 없다”며 “그렇기 때문에 핵심 인력을 모으고 국내에서 처음으로 하는 CAR-T세포 치료제 생산을 위해 GMP 시설 구축이 필요했던 것”이라고 설명했다.
그는 “이 기반 위에서 림프종 임상 시작이 목표이고 백혈병, 다발성골수종까지 범위를 넓혀가겠다”며 “혈액암뿐만 아니라 고형암에서도 CAR-T를 쓸 수 있도록 기술을 개발하고 새로운 길을 나아가는 것이 목표”라고 강조했다.
◆ CAR-T 기술과 큐로셀 차별성
환자 혈액 채취→ 백혈구에서 T세포(면역세포) 분리 → 유전자 조작을 통해 T세포에 특정 암을 인식하는 유전자(CAR)를 삽입 → *T세포에 있는 면역 관문 수용체(PD1, TIGIT) 2종 제거 → T세포 배양 → 환자에게 투약.
*큐로셀은 면역세포(T세포)에 있는 면역 관문 수용체 2종(PD1, TIGIT)을 제거해 CAR-T세포를 만드는 기술이 독보적이다. 암세포는 T세포 표면 면역관문 수용체에 달라 붙어 T세포 면역 기능을 무력화 시킨다. 대다수 바이오 기업은 PD1이라는 면역 관문 수용체를 제거하는 것과 달리 큐로셀은 PD1과 TIGIT을 제거해 CAR-T 효능을 극대화하고 있다.
◆ 용어 설명
☞ 림프구(Lymphocyte)
림프구는 면역계를 구성하는 중심 세포다. 우리 몸 속에는 감염원으로부터 신체를 보호하는 면역계 세포 ‘백혈구’가 있다. 전체 백혈구 중 약 25% 정도를 차지하는 세포를 림프구라 일컫는다. 림프구는 적응 면역과 항원 특이성, 수용체의 다양성, 기억, 자기 비자기 구분이라는 특징을 지닌다. 림프구는 조혈모세포에서 만들어지며 성숙된 림프구는 기능에 따라 B세포와 T세포로 나눌 수 있다.
☞ T세포(T cell)
면역 반응에 관여하는 림프구는 B세포와 T세포가 있다. B세포는 체내에 침입한 세균·바이러스에 대항하는 항체를 만든다. T세포는 몸속에서 여러 기능을 하는데, 그중 면역에서 기억능력을 지녀 B세포에 정보를 제공해 항체 생성을 돕는다. 특히 T세포는 병원체에 감염된 세포를 직접 사멸시키는 능력을 지닌다. 이 뿐만 아니라 면역 활동을 적절히 조절하는 기능도 지닌다.
☞ CAR-T세포 치료제(Chimeric Antigen Receptor T cell Therapy)
환자 혈액에서 얻은 T세포와 암을 잘 인지하는 키메릭 항원 수용체(CAR)를 유전자 조작해 만든 세포 치료제다. 환자의 혈액에서 T세포를 추출한 뒤 바이러스 등을 이용해 암세포에 반응하는 수용체 DNA를 T세포에 주입하고 증식 시켜 몸속에 넣어주는 방식이다. 암세포와 수용체가 ‘열쇠와 자물쇠’처럼 결합하면 T세포는 암세포를 공격하는 원리다. CAR-T 세포 치료제는 정상 세포 손상을 줄이면서 효과적으로 암세포를 사멸할 수 있는 차세대 항암제다.
